我一直认为,在和人类一起进化了上万年后,HBV可能是最为妖而不孽的人类病毒:① 选择感染的宿主细胞是终分化却非终分裂、有超强再生能力的肝细胞;②整体上肝组织呈免疫“惰性”;③ 病毒自身缺乏致细胞病变效应(CPE),其致病主要是宿主免疫通过杀伤清除感染肝细胞带来的持续肝脏炎症所致;④ “冗余”的HBeAg、超量的HBsAg,甚至病毒复制的关键蛋白pol的泛免疫抑制作用,使得慢性HBV感染呈现出隐匿性(stealthy),HBV成为能够与宿主人类“和平共处”的最小DNA病毒(Puzzle:为何诱来的固有免疫抑制都是HBV特异的?比如,没听说CHB患者卡波氏肉瘤风险增加)。
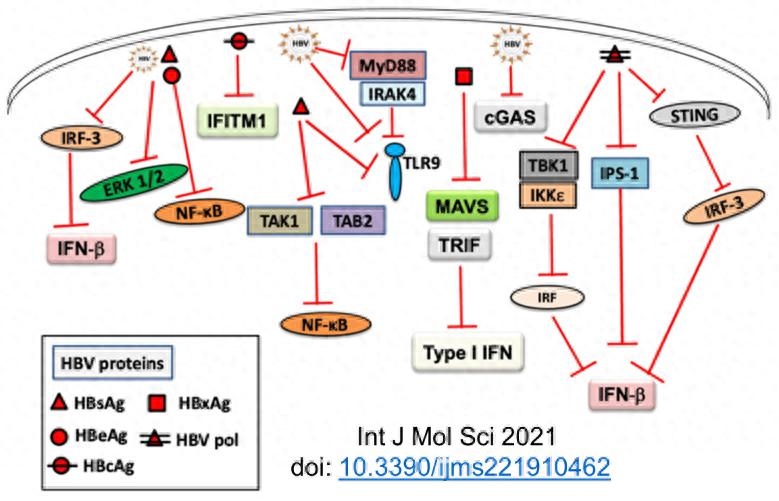
我国的慢性感染主要以母婴垂直传播和婴幼儿早期暴露等为主,疾病进程时间漫长。出现肝硬化/肝硬化失代偿等终末期肝病及原发性肝细胞癌的时间往往需要30~50年之久。这意味着其在人类完成传宗接代前少有对宿主生命的威胁,甚至在人类农业革命和后续的医疗进步带来长寿前,HBV慢性感染对人类都不会带来明显的寿命影响。
有逆转录活性的Pol蛋白凭甚不胡乱逆转录细胞质中丰度颇高的mRNA?
作为真核生物,与原核生物最大的差别就是用核膜和线粒体膜将荷载了遗传信息的DNA与mRNA分开。人类在长期的与病毒等病原体的博弈过程中获得了能够对病原体感染做出快速应答的固有免疫。核膜的存在让真核细胞能够快速地识别不该在胞质出现的病原体DNA并启动固有免疫以清除。
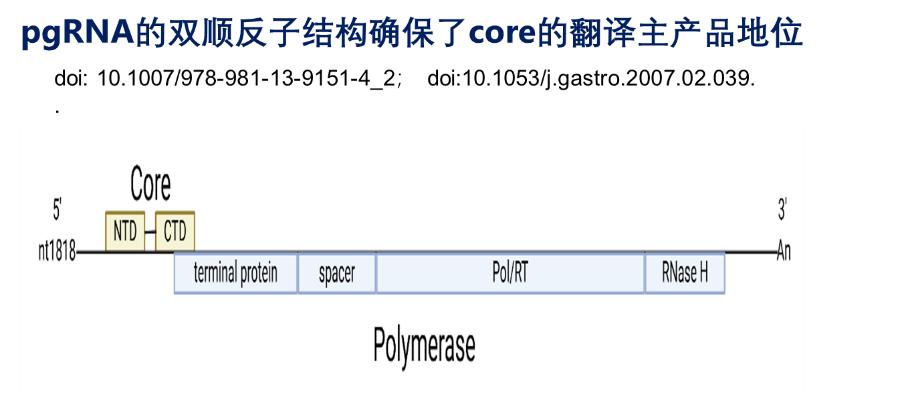
就HBV而言,其复制源头cccDNA存在于细胞核内,并伪装成最接近宿主DNA的闭环mini-chromosome,病毒复制过程遵守“胞核DNA(cccDNA)→ 胞质mRNA→蛋白质”的中心法则。然而,以HBV前基因组RNA(pgRNA)为模板逆转录合成子代病毒rcDNA的过程却恰恰是在胞质发生。为了确保新合成出的子代病毒DNA不被胞质中的模式识别受体发现,cccDNA会通过表达出超量的、能够自发形成二聚体并快速自我组装成衣壳的core蛋白。pgRNA的双顺反子结构确保了core的翻译主产品地位,且唯有在core蛋白足量表达后才通过挟持宿主因子TIAR关闭core的翻译以使pgRNA能够表达P蛋白的机制(详见2023-09-13的片警实验室公众号:认识HBV DNA复制过程中的精细调控 )。但这似乎还不足以确保新翻译合成中的P蛋白一点作孽的机会都不给。
我们知道,编码HBeAg 前体蛋白的preC mRNA,序列上与pgRNA几乎完全一样,仅在mRNA的5’端多了一段约30nt长的碱基序列。但是P蛋白却是非常严格地选择性地结合pgRNA,而不是preC mRNA。基于这样的事实我们推测,介导与pgRNA ε区环柄状结构域结合的P蛋白一旦被翻译出来,就会抓住离其最近的pgRNA翻译模板,即抓自己。因为但凡给P蛋白一个游离的机会,它就会有机会抓到丰度相对更高的preC mRNA,特别是在HBeAg阳性状态下。从另一个角度讲,preC mRNA由于其5'端多出的序列含有前C蛋白的ATG,使之更加难有机会翻译出P蛋白来。事实上,preC mRNA极少发现被包裹在核衣壳内,也支持了新翻译P蛋白的抓自身的mRNA--pgRNA的cis-binding推测。但我们在当时并无手段来验证我们的这个“翻译状态下的P蛋白抓其翻译模板pgRNA自身”的想法。直到南方医的孙剑教授和美国的黄琦博士一起利用接受拉米夫定并发生耐药过程各时间节点的系列样本进行突变检测及野生、突变构成比计算,来推算慢乙肝患者肝组织内的cccDNA 半衰期。待他们的文章在Hepatology杂志online 后,我们即刻将上述推测包装成 commentary 投稿Hepatology并以极快的速度为杂志所接受,并于2021年4月26日online发表。
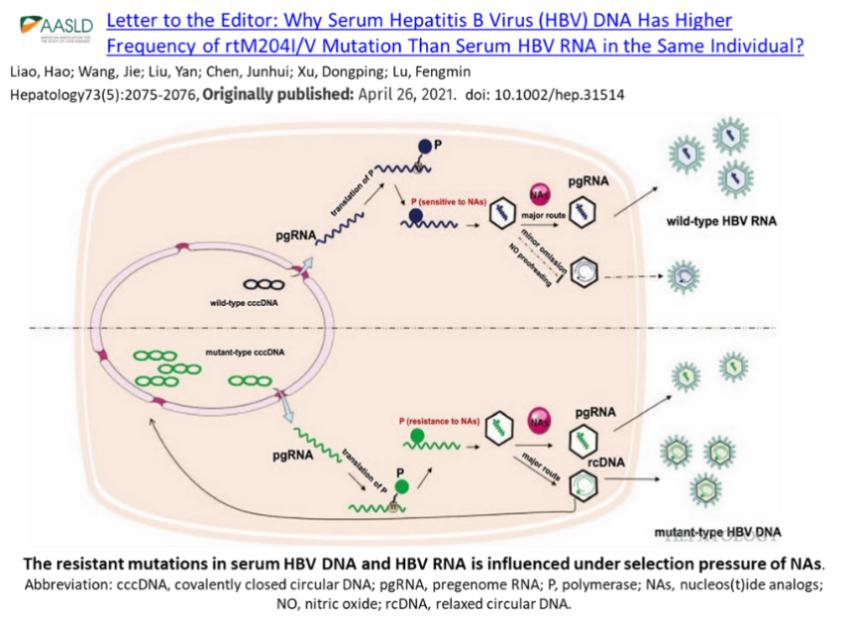
在这个模型里,转录自突变cccDNA的携带了耐药突变信息的pgRNA翻译出耐药的P蛋白,耐药的P蛋白“反身”抓住其mRNA翻译模板--携带了耐药突变信息的pgRNA。在衣壳内,由于携带能抵抗NAs药物的竞争性抑制作用,耐药P蛋白能更有效地将耐药的pgRNA模板逆转录合成出耐药的子代病毒DNA,一方面释放从头感染新的肝细胞,另一方面走内补充途径入核形成cccDNA;反观来自野生cccDNA的野生的pgRNA转录出的野生P蛋白,抓住其野生的模板pgRNA后,由于不耐药逆转录受限而多以RNA病毒样颗粒释放。这种巨大的新cccDNA形成能力的差异会造成野生cccDNA以较快的速度被耐药突变cccDNA所代替。
2024年,来自洛克菲勒大学Charles M. Rice(因HCV研究而获得2020年的诺奖)和William M. Schneide实验室的Yingpu Yu等在cell杂志发文,用极为简约的实验设计验证了我们的推测。该研究在第三方提供足量core蛋白的前提下,将不同比例的野生型pgRNA和P蛋白失能突变的pgRNA(Pol mut pgRNA)共转染到Huh7.5-NTCP细胞中,并在转染两天后检测细胞中逆转录形成的HBV DNA中野生型和突变型的占比,以此来表征哪种类型的pgRNA被P蛋白结合并逆转录为HBV DNA。结果发现,纵使Pol mut pgRNA在共转染体系中占据>90%的比例,形成的HBV DNA依然几乎全部都是野生型。这提示WT pgRNA翻译形成的有功能的P蛋白仅仅顺式作用于其自身pgRNA启动逆转录,而不会结合数量上远远多于WT pgRNA的Pol mut pgRNA(见下图)。
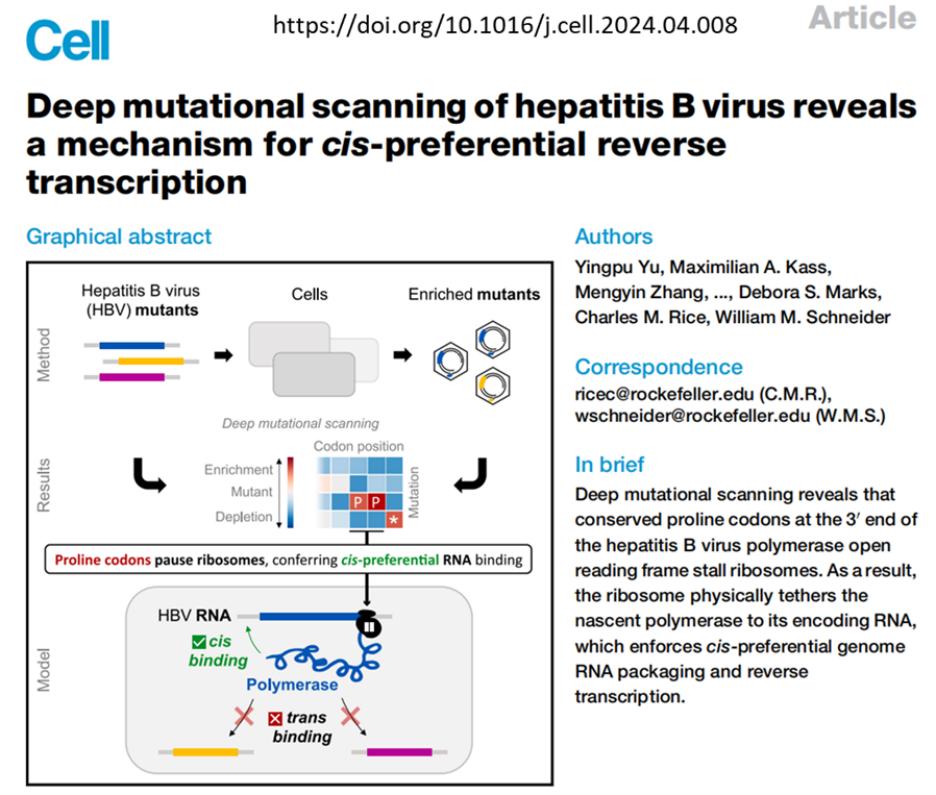
不仅如此,他们还为这种合成中的P蛋白 “抓自身”(cis-binding)找到了机制:核糖体沿pgRNA模板将P蛋白翻译至羧基端的脯氨酸处时会出现短暂的氨基酸链延伸停滞,如此:Ribosome pausing tethers HBV Pol to RNA, enforcing cis-preferential reverse transcription。此外,既往研究表明HBV病毒P蛋白半衰期短,E3 泛素连接酶 TRIM21促进其K260 和 K283 位点泛素化修饰,并通过K48 连接的泛素蛋白酶体途径加速降解。这可能为未能结合pgRNA的P蛋白一旦出现在胞浆时便会被快速清除而提供了保障[doi: 10.3390/v12030346]。同时,由P蛋白先被合成出的TP 结构域第63位酪氨酸提供羟基的蛋白质priming引发的核苷酸链延伸和随后的跳转启动rcDNA负链合成,都依赖于pgRNA的茎环结构及特定序列,也给P蛋白的逆转录活性加上了一把“安全锁”[
doi:10.1073/pnas.2022373118]。这些机制避免了具有逆转录酶/ DNA聚合酶和RNase H酶活性的病毒P蛋白在细胞内自由地漂泊,从而避免了可能因某些个宿主RNA被逆转录成DNA,诱发固有免疫杀害感染肝细胞,保证了HBV感染不会带来直接致细胞病变效应(CPE),使HBV“妖而不孽”。而这,才是该CELL文章研究发现的最有意义所在。
但是,慢性乙肝的自然进程中有着复杂的病毒与宿主的互作,上述精确的保障机制会不会也有意外?不妨拭目以待。

注:廖昊博士(右侧),上文hepatology杂志 letter的第一作者,现于深圳市第三人民医院检验医学部工作。
来源:片警实验室
- 随机文章
- 热门文章
- 热评文章
- 《2024成都咖啡行业调查报告》发布:90后是咖啡消费主力军今
- 2024年天津市租赁贸易进出口1458亿元规模居全国首位今日头
- 淄博、滨州机场建设传来新消息,山东市市通机场蓄势起航今日
- 福建海警位金门附近海域依法开展常态化执法巡查
- 2024年环县首创了一批示范推广的环县模式
- 湖南省岳阳市水务集团有限公司党委书记、董事长李宇宙接受审查
- 这4个毁眼行为不要再做了!再不注意,眼睛真的要报废了今日
- 刚果(金)东部冲突愈演愈烈,已致约7000人死亡













 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号